Доклиническая оценка качества хлеба белого из муки пшеничной первого сорта, полученной при помощи технологического вспомогательного средства «EnzoWay 5.02»

Е.И. Пономарева, доктор техн. наук, профессор кафедры технологии хлебопекарного, кондитерского, макаронного и зерноперерабатывающего производств ФГБОУ ВО «Воронежский государственный университет инженерных технологий»
В.В. Петриченко, канд. техн. наук, генеральный директор «Грейн Ингредиент»,
Д.Ю. Бугримов, канд. мед. наук, доцент кафедры патологической анатомии «Воронежского государственного медицинского университета им. Н.Н. Бурденко»
Н.Н. Алехина, канд. техн. наук, доцент кафедры технологии хлебопекарного, кондитерского, макаронного и зерноперерабатывающего производств ФГБОУ ВО «Воронежский государственный университет инженерных технологий»
М.Г. Иванов, аспирант кафедры технологии хлебопекарного, кондитерского, макаронного и зерноперерабатывающего производств ФГБОУ ВО «Воронежский государственный университет инженерных технологий»
Резюме В последнее время намечена тенденция снижения хлебопекарных свойств муки. Применение на стадии отволаживания зерна технологического вспомогательного средства «EnzoWay 5.02» позволяет повысить выход муки, ее биологическую ценность, содержание клейковины. Хлеб, полученный из нее, отличается большей пористостью и удельным объемом. При этом необходимо провести доклиническую оценку качеству хлеба, полученного из муки с применением технологического вспомогательного средства «EnzoWay 5.02». Целью исследования явилось изучения влияния технологического вспомогательного средства «EnzoWay 5.02» на биохимические параметры, антиоксидантный статус, гистохимические и морфологические изменения в организме крыс методом in vivo. Установлено, что при включении в рацион питания хлеба из пшеничной муки, полученной с применением ферментных препаратов, зафиксирована тенденция более выраженного пищеварения, более улучшенного процесса метаболизма в отделах кишечника, положительное регуляторно-моделирующие влияние на антиоксидантную активность крови.
С момента создания промышленного мукомолья специалисты отрасли активно ищут различные способы повышения эффективности переработки зерна. Технологию переработки совершенствуют в основном за счет улучшения конструкций основного оборудования и удлинения технологической цепочки переработки зерна. Вместе с тем, приоритетным фактором при помоле зерна остаются его мукомольные свойства [1].
Приоритетной тенденцией современных исследований в этой области является подбор параметров отволаживания (продолжительности, температуры, влажности) в сочетании с промежуточными стадиями энергетических воздействий в целях достижения таких структурно-механических свойств зерна, при которых обеспечиваются минимальные потери его ценных составляющих при последующем размоле с сохранением высокого качества продуктов помола. Важно отметить, что при соблюдении условий низкой зольности (высокой белизны) продуктов помола с оболочками зерна теряются наиболее ценные с биологической точки зрения, алейроновый слой (его содержание в зерновке колеблется в пределах 6-13 %), обогащенный фенольными кислотами, антоцианами, ответственными за его антиоксидантный свойства, микроэлементами, каротиноидами, витаминами группы В, токоферолами [2, 3]. Однако предлагаемые способы интенсификации кондиционирования зерна (вакуумное, обработка насыщения паром, воздействие ИК- или СВЧ-излучением, ультразвуком) не нашли широкого применения на мельницах из-за высокой энергоемкости, сложности ведения технологического процесса и высокой стоимости эксплуатируемого оборудования.
Хорошие мукомольные свойства пшеницы свидетельствуют о возможном получении высоких выходов муки при минимальных затратах. Однако в настоящее время мукомольным предприятиям достаточно трудно регулярно закупать высококачественную пшеницу в связи с ее дефицитом и высокой стоимостью на рынке.
Специалистами ООО «Грейн Ингредиент» предложен способ, отличающийся тем, что при гидротермической обработке зерно обрабатывается ферментами в рамках действующих на мельницах технологических схем с использованием стандартных емкостей и дозаторов без дополнительных капиталовложений. Для интенсификации кондиционирования предположенным методом увлажнение и отволаживание (одно- или двухэтапное) зерна пшеницы можно проводить любым из существующих на мукомольных заводах способом, в зависимости от комплектации оборудования.
Под воздействием композиции ферментов вспомогательного технологического средства (ТВС) «EnzoWay 5.02» при отволаживании зерна ослабляются связи эндосперма и алейронового слоя зерна, при кондиционировании повышается проницаемость зерна для влаги, быстрее разрыхляется структура эндосперма и зерно приобретает свойства упруго-пластичного и даже пластичного тела, что приводит к оптимизации его технологических свойств и к сокращению продолжительности кондиционирования. В состав ТВС «EnzoWay 5.02» входят ферментные препараты: целлюлазы и ксиланазы. Целлюлазы получают из микробных культур рода Trichoderma или Aspergillus [4].
В результате помола подготовленного таким образом зерна повышается общий выход муки при одновременном увеличении выхода высоких сортов, повышается ее биологическая ценность, возрастает количество клейковины за счет попадания в продукт помола периферийных частей эндосперма и улучшается ее качество. Кроме того, ферментативный гидролиз оболочек зерна позволяет снизить количество тяжелых металлов в продуктах помола, вследствие десорбции ионов металлов, связанных с некрахмальными полисахаридами, при солюбилизации структур оболочек [5, 6, 7].
Применение муки, полученной из зерна предварительно обработанного ТВС «EnzoWay 5.02» в производстве хлебобулочных изделий показало, что хлеб с его применением отличался большей пористостью и удельным объемом [8].
При этом необходимо определить влияние ТВС «EnzoWay 5.02», вводимого на стадии отволаживания зерна, на биохимические параметры, гистохимические и морфологические изменения в организме.
Целью исследований явилось изучение влияния технологического вспомогательного средства «EnzoWay 5.02» на биохимические параметры, антиоксидантный статус, гистохимические и морфологические изменения в организме крыс методом in vivo.
Материал и методы
Для исследований использовали муку пшеничную хлебопекарную первого сорта (ГОСТ Р 52189-2003), дрожжи хлебопекарные прессованные (ГОСТ Р 54731-2011), соль поваренную пищевую (ГОСТ Р 51574-2000), воду питьевую (СанПиН 2.1.4.1074-01), технологическое вспомогательное средство «EnzoWay 5.02» (ТР ТС 021/2011).
Для исследования были взяты изделия: 1 − хлеб белый из муки пшеничной первого сорта, 2 − хлеб белый из муки пшеничной первого сорта, полученной при помощи технологического вспомогательного средства (ТВС) «EnzoWay 5.02». Тесто готовили безопарным способом по рецептуре, указанной в табл. 1.
Таблица 1. Рецептура и режимы приготовления хлеба из муки пшеничной хлебопекарной первого сорта безопарным способом
| Наименование сырья и показателей процесса | Расход сырья и параметры процесса |
|---|---|
| Мука пшеничная хлебопекарная первого сорта*, кг |
100,0 |
| Дрожжи хлебопекарные прессованные, кг |
2,25 |
| Соль поваренная пищевая, кг |
1,3 |
| Вода, кг |
по расчету |
| Влажность теста, % |
44,5 |
| Температура начальная, °С |
26–28 |
| Кислотность конечная, град |
3,0 |
| Продолжительность брожения, мин |
90,0 |
|
*в контрольной группе применяли муку пшеничную хлебопекарную первого сорта, полученную при помощи ТВС ««EnzoWay 5.02»» |
|
Объектом изучения влияния ТВС ««EnzoWay 5.02» на показатели крови являлись половозрелые белые беспородные крысы-самцы с начальным возрастом 4 месяца при соблюдении требований хронобиологии. Масса тела животных варьировалась от 130 до 230 г соответственно возрасту.
Экспериментальная возрастная модель биообъекта соответствовала от 4 до 6 мес., что эквивалентно возрасту для человека от 22 до 30 лет. Выбор такой возрастной корреляции соответствовал требованиям эксперимента: возраст наиболее активного функционирования млекопитающих. В соответствии с планом эксперимента были сформированы 2 группы по 2 животных.
В первой группе (контрольной) животные находились в свободном режиме существования и в пищу получали стандартный суточный водный рацион и «сухой кормовой компонент» в виде хлеба из муки пшеничной первого сорта без обработки. Во второй группе (опытной) животные находились в свободном режиме существования и в пищу получали стандартный суточный водный рацион и «сухой кормовой компонент» в виде хлеба из муки пшеничной первого сорта, полученной при помощи технологического вспомогательного средства «EnzoWay 5.02». Продолжительность исследования составляла 30 сут.
После вскрытия животных определяли следующие показатели: маркеры окислительного стресса, регуляторов водно-солевого обмена, метаболизма витаминов. К маркерам окислительного стресса относятся малоновый диальдегид (MDA), сульфидные белковые группы (SH-g), супероксиддисмутаза (SOD), С – реактивный белок (СRP), общее суммарное окисление белков (Oxystat); к маркерам регуляторов водно-солевого обмена -ренин (REN); цистатин С (CTS3); к маркерам метаболизма витаминов - ретинол (А); биотин (B7).
Материалом для изучения морфометрических показателей служили участки тонкого кишечника размерами 1,3-1,5 см, взятые на расстоянии 12-15 см от желудка и фрагменты толстой кишки, взятые на расстоянии 5-7 см от прямой кишки.
Концентрацию щелочной фосфатазы (ЩФ) исчерченной каемки, определяющей активность процессов всасывания и являющейся системой трансмембранного переноса, оценивали в средней части ворсинки, то есть у полностью дифференцированных клеток, обеспечивающих высокую активность транспортных процессов.
Применяя метод одновременного азосочетания с инкубацией в среде, содержащей α-нафтилфосфат и прочный синий PP идентифицировали активность ЩФ в щеточной каемке энтероцитов тонкой кишки и в эндотелиоцитах микроциркуляторного русла толстой кишки. Активность фермента определялась в виде черного канта (прерывающегося, тонкого и толстого, фрагментарного или сплошного) по апикальному полюсу энтероцитов ворсинок, в щеточной каемке.
Фотосъемка гистологических препаратов проведена с использованием компьютерного комплекса анализаторов изображений на базе OPTIMAS S 15 & 20.
Качественную и количественную характеристику микрообъектов органов проводили от каждого животного с использованием бинокулярного микроскопа OPTIKA Serie DM-15&20, снабженного цифровой видеокамерой, компьютерная программа Optika Micro Image Analysis Software En. Ver 1.0. Анализ изображения проводился с использованием программы Image J 1.38х. Для этой цели каждая предварительно полученная микрофотография переводилась в восьмибитное черно-белое изображение. Проводилась оценка по светооптической плотности только маркированных изображений, эквивалентных одинаково максимальной хромности выраженной в Pixels.
Полученные данные обрабатывали статистическим методом на ПЭВМ Hewlett-Packard модели HP Compaq 6710b, процесcор Intel (R) Core (TM) 2 Duo CPU T8100 @ 2.10 Ghz, RAM 1015Мб, 32-разрядная операционная система с помощью стандартного пакета статистических функций “Microsoft Excel” – 2007, “Statistika” – 6.0 for Windows, “SPSS” 13.0. for Windows.
Выявление дегидрогеназ (сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ), глюкоза 6-фосфатдегидрогеназы (Г6-ФДГ)), проводили с использованием тетразолий-редуктазных методик; соответствующего субстрата и соли «нитро-СТ».
Результаты и обсуждения
Анализ окислительного стресса в исследовании показал, что у животных контрольной группы наблюдался рост всех обозначенных маркеров (табл. 2).
Таблица 2. Соотношение биохимических маркеров у крыс в исследовании
| Маркеры | Значения маркеров в группах животных | |
|---|---|---|
| контрольная | опытная | |
|
Маркеры окислительного стресса
|
||
| Малоновый диальдегид (MDA), нмоль/мл |
2,3±0,2 |
0,44±0,04 |
| SH-группы (SH-g), у.е. |
72,5±2,9 |
64,2±5,4 |
| Супероксиддисмутаза (SOD), у.е. |
297.6±28,4 |
148,1±9,7 |
| С-реактивный белок (СRP), мг/л |
567,4±24,1 |
213,8±34,1 |
| Общее суммарное окисление белков (Oxystat), мкмоль/л |
1108,4±97,4 |
653,7±47,2 |
|
Маркеры регуляторов водно-солевого обмена
|
||
| >Ренин (REN), мкМЕ/мл |
82,6±12,5 |
12,7±2,3 |
| Цистатин С (CTS3), мг/л |
5,8±1,1 |
1,2±0,2 |
| Маркеры метаболизма витаминов | ||
| Ретинол (А), мкг/мл |
0,18±0,01 |
0,37±0,06 |
| Биотин (В7), мкг/мл |
0,42±0,02 |
0,34±0,04 |
MDA – это эндогенный альдегид, образующийся в результате метаболизма арахидоновой и других полиненасыщенных жирных кислот.
Вместе с каталазой и другими антиоксидантными ферментами SOD защищает организм человека от постоянно образующихся высокотоксичных кислородных радикалов. Таким образом, она играет важнейшую роль в антиоксидантной защите практически всех клеток, так или иначе находящихся в контакте с кислородом. CRP играет важную роль в удалении из организма биоактивных лизофосфолипидов и жирных кислот, образующихся при повреждении собственных клеточных мембран.
OxyStat – оценка общей концентрации перекиси в образце с помощью простого и быстрого метода определения. Существует прямая зависимость между присутствием свободных радикалов и циркулирующими биологическими пероксидами, таким образом, результаты измерений позволяют оценить окислительный статус в любых биологических образцах.
Под действием ренина образуется ангиотензин, а тот вызывает секрецию альдостерона. Образование ангиотензиногена происходит в печени и стимулируется глюкокортикоидами и эстрогенами. Ренин гидролизует пептидную связь в молекуле ангиотензиногена и отщепляет N-концевой декапептид (ангиотензин I), не имеющий биологической активности.
Цистатин С содержится в плазме крови человека, функцию выведения белка из организма осуществляют почки. Исследования показали, что уровень цистатина С является более точным маркером почечной функции, чем уровень креатинина.
Ретинол участвует в окислительно-восстановительных процессах, регуляции синтеза белков, способствует нормальному обмену веществ, функции клеточных и субклеточных мембран, играет важную роль в формировании костей и зубов, а также жировых отложений; необходим для роста новых клеток, замедляет процесс старения.
Биотин является коферментом различных ферментов, в том числе и транскарбоксилаз. Участвует в синтезе пуриновых нуклеотидов. Является источником серы, которая принимает участие в синтезе коллагена. С участием биотина протекают реакции активирования и переноса СО2.
Эти данные свидетельствуют о том, что условия кормления животных контрольной группы привели к тому, что в организме стал активно высвобождаться свободный 3-х валентный кислород (высокие значения MDA и Oxystat) и отягощать кислотную среду сыворотки крови (и организма в целом). Это определялось ростом С-реактивного белка и супероксиддисмутазы в сравнении с базовыми значениями этих показателей и уровнем их содержания у животных опытной группы. Высокие значения SOD в сочетании с доминирующими значениями окисления белков свидетельствуют о том, что рацион питания животных контрольной группы приводил к нарушению защитно-приспособительных механизмов организма в борьбе с высокими уровнем перекисей, которые образовывались по данным исследования.
При этом у животных опытной группы наоборот, наблюдалось активное уменьшение всех маркеров окислительного стресса (MDA, SH-g, SOD и СRP) на фоне низких значений суммарного окисления белков в сыворотке крови. Полученные результаты у животных опытной группы свидетельствуют, что условия проведения исследования положительно сказались на уровне общей концентрации перекисей в организме, рацион питания если и провоцировал их рост, то все защитные механизмы отработали слаженно, и концентрация маркеров не превышала базовые контрольные значения здоровых половозрелых особей.
Анализ маркеров водно-солевого обмена показал, что у животных контрольной группы в отличие от опытной группы наблюдалось задержка уровня натрия и калия. Уровень цистатина С был в 3,8 раза выше у животных контрольной группы по сравнению с особями опытной группы (табл. 2). По результатам исследования можно констатировать то, что рацион питания животных опытной группы был более адекватным (в сравнении с контрольной группой) и не вызывал нарушения обмена солей (один из прогностических признаков задержки солей и интерстициальной жидкости в организме экспериментальных животных контрольной группы).
Динамика метаболизма витаминов (А и В7) полностью соответствовала предыдущей описанной картине динамики маркеров: у животных контрольной группы в 3 раза показатель А был ниже, чем у животных опытной группы, при этом В7 снижался у животных опытной группы не значительно в сравнении с данными по контрольной группе. По-видимому, изменения В7 носят более отдаленный прогностический характер и условия эксперимента не позволяют его оценить в предложенные сроки.
Гистохимические морфологические исследования слизистой оболочек тонкого и толстого кишечника носили следующий характер (рис. 1): наблюдалось усиление активности ЩФ энтероцитов. ЩФ – показатель трансцеллюлярного транспорта метаболитов и проницаемости клеточных мембран.
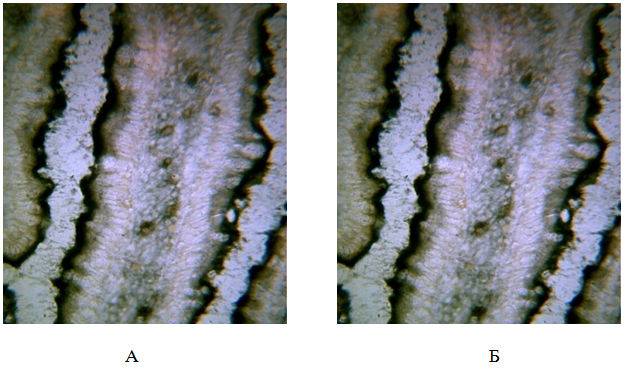
Рис. 1 – Щелочная фосфотаза в энтероцитах слизистой оболочки тонкого кишечника. А – контрольная группа; Б – опытная группа (х400).
Активность Г6-ФДГ повышалась. Активность СДГ эпителиоцитов ворсинок тощей кишки была выше, чем в биоконтроле. Наблюдалось снижение активности ЛДГ. Суммарный процентный показатель выявил разнонаправленность эффектов в реакциях ЩФ – повышение в 100 % случаев, Г6-ФДГ повышение в 90 %. Эффекты СДГ и ЛДГ констатировали повышение аэробных и анаэробных процессов в 40 % и 28 % случаев; и их снижение в 60 % и 72 % соответственно.
Изучение состояния системы проницаемости микроциркуляторного русла толстой кишки является важной характеристикой в оценке степени чувствительности обменных процессов. Качественная оценка динамики активности ЩФ демонстрирует ее распределение в виде нитей и гранул округлой и овальной формы эквивалентно капиллярному рисунку межкриптальной стромы (рис. 1 Б).
Важнейшими звеньями окислительной системы являются сукцинатдегидрогеназа (СДГ) и лактатдегидрогеназа (ЛДГ). Данные оксиредуктазы организованы в митохондриях комплексными ансамблями с правильными промежутками. Важно отметить, что превращение сукцината посредством сукцинатдегидрогеназы является единственной дегидрогеназной реакцией цикла лимонной кислоты, в ходе которой осуществляется прямой перенос водорода с субстрата на флавопротеин без участия NAD+.
Сукцинатдегидрогеназная система митохондрий определяет биоэнергетику клетки, являясь маркером митохондрий, и весьма чувствительна к воздействию экстремальных факторов, нарушающим процессы окислительного фосфорилирования. По активности СДГ и ЛДГ можно судить о состоянии цикла Кребса. Уровень щелочной фосфатазы доминировал в тонком кишечнике у животных опытной группы в сравнении с контрольной группой (рис. 1, табл. 3).
Таблица 3. Показатели средних значений гистоэнзимологических реакций слизистой тонкого кишечника в исследовании (Рх)
|
Группа животных |
Значение показателей |
|||
|---|---|---|---|---|
|
Щелочная фосфатаза (ЩФ) |
Глюкоза-6-фосфат (Г6-ФДГ) |
Суксцинат-дегидрогеназа (СДГ) |
Лактат-дегидрогеназа (ЛДГ) |
|
| контрольная |
350909 |
213760,0 |
344591,5 |
297571,7 |
| опытная |
424275,6 |
327274,0 |
305535,8 |
229014,2 |
В результате исследования установлено, что у животных контрольной группы активность Г6-ФДГ в тонком кишечнике была ниже, чем у животных опытной группы.
Повышение активности СДГ в тонком кишечнике отмечалось у животных опытной группы, по сравнению с животными контрольной группы.
Активность ЛДГ тонкого кишечника незначительно угнеталась в обеих экспериментальных группах (табл. 3).
Суммарный процентный показатель направленности эффектов гистоэнзимологических реакций слизистой оболочки тощей кишки в исследовании выявил повышение ЩФ, снижение активности Г6-ФДГ. Наблюдалась дисгармония взаимности аэробных и анаэробных процессов: повышение СДГ у животных контрольной группы, а ЛДГ у животных 2-й опытной группы (рис. 2).
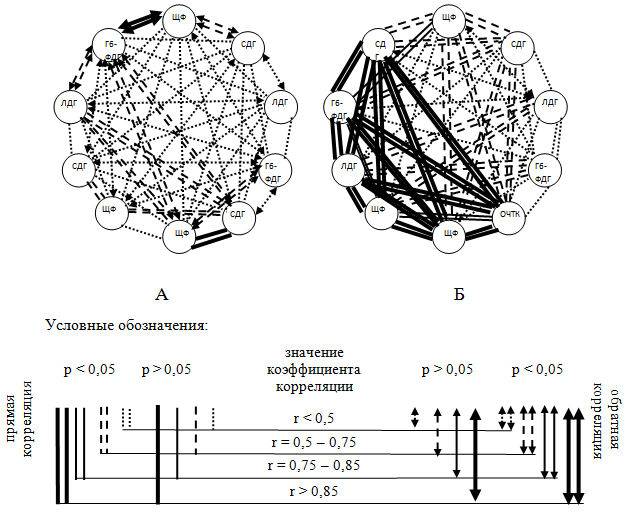
Рис. 2 – Модель корреляционной динамики гистохимических маркеров в слизистой тонкого кишечника: А – контрольная группа, Б – опытная группа
Гистоэнзимологический анализ состояния слизистой толстого кишечника показал, что у животных контрольной группы щелочная фосфатаза доминировала по сравнению с данными опытной возрастной группы; глюкоза-6-фосфатдегидрогеназа в 2 раза превышала оптический уровень у животных опытной группы в сравнении с животными контрольной группы; СДГ и ЛДГ слизистой толстого кишечника доминировал над уровнями в слизистой контрольной группы на 35 % и 45 % соответственно (табл. 4).
Таблица 4. Показатели средних значений гистоэнзимологических реакций слизистой толстого кишечника в исследовании (Рх)
|
Группа животных |
Значение показателей |
|||
|---|---|---|---|---|
|
Щелочная фосфатаза (ЩФ) |
Глюкоза-6-фосфат (Г6-ФДГ) |
Суксцинат-дегидрогеназа (СДГ) |
Лактат-дегидрогеназа (ЛДГ) |
|
| контрольная |
448346,7 |
117953,0 |
183848,5 |
212872,9 |
| опытная |
305646,1 |
231491,0 |
230754,1 |
280704,8 |
Корреляционный анализ гистоэнзимологических критериев слизистой толстого кишечника в эксперименте (рис. 3) показал сильные положительные достоверные связи между СДГ и ЛДГ во всех группах исследования.
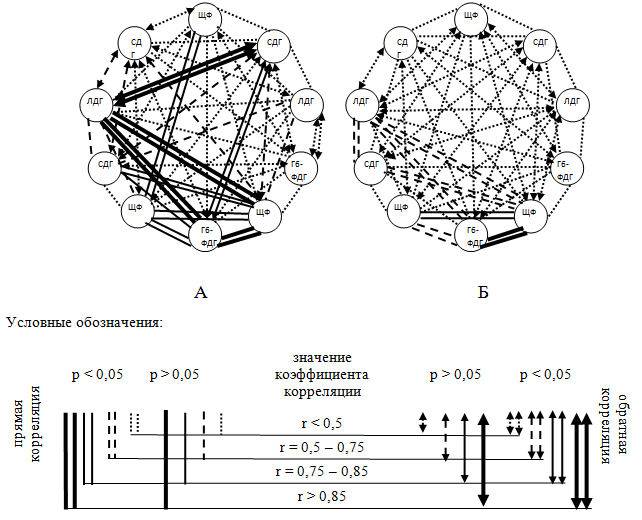
Рис. 3 – Модель корреляционной динамики гистохимических маркеров в слизистой толстого кишечника: А – контрольная группа, Б – опытная группа
Таким образом, методом in vivo на половозрелых белых крысах была доказана эффективность применения технологического вспомогательного средства «EnzoWay 5.02» на стадии отволаживании зерна пшеницы. На фоне включения в рацион питания хлеба из пшеничной муки, полученной с применением ферментных препаратов, зафиксирована тенденция более выраженного пищеварения, более улучшенного процесса метаболизма в отделах кишечника, положительное регуляторно-моделирующие влияние на антиоксидантную активность крови и не происходит изменения водно-солевого баланса. Следовательно, результаты клинических испытаний на крысах подтвердили, что хлеб с применением технологического вспомогательного средства обладает комплексом полезных свойств, будет способствовать сохранению здоровья и повышению качества жизни людей.
Литература
- Бутковский, В. А. Современная техника и технология производства муки / В. А. Бутковский, Л. С. Галкина, Г. Е. Птушкина. – М. : ДеЛи Принт, 2006. – 319 с.
- Hand Pham Van. Fenolic acid composition of sprouted wheats by ultraperformance liquid chromatography (UPLC) and their antioxidant activities / Hung Pham Van, Hatcher David W., Barker Wendy // Food Chem. – 2011. – 126, № 4. – P. 1896-1901.
- McKevith, Brigid. Nutritional aspects of cereals / McKevith Brigid // Nutritional Bulletin. – 2004. – 29, № 2. – P. 111-142.
- Пономарева, Е. И. Обогащение пшеничной муки ферментами и витаминами / Е. И. Пономарева, В. В. Петриченко, М. Г. Иванов // Материалы IV Международной научно-технической конференции «Новое в технологии и технике функциональных продуктов на основе медико-биологических воззрений» – Воронеж: ВГУИТ, 2014. - С. 306-308.
- Кузнецова, Е. А. Накопление тяжелых металлов в зерновых культурах и пути снижения их содержания / Е. А. Кузнецова // Гигиена и санитария. – 2007. - № 4. – С. 50-53.
- Способ увеличения выхода муки / Е. И. Пономарева, В. В. Петриченко, М. Г. Иванов, А. А. Грибоедова // Материалы международной научно-технической конференции «Продовольственная безопасность: научное, кадровое и информационное обеспечение». – Воронеж: ВГУИТ, 2014 - С. 17-18.
- Композиция ферментов для хлебобулочных изделий / Е. И. Пономарева, О. Н. Воропаева, В. В. Петриченко, М. Г. Иванов // Материалы XI Международной научно-практической конференции «Современные концепции научных исследований». - Москва, 2015. – № 2. - С. 108-109.
- Исследование влияния применения технологического вспомогательного средства Enzoway 5.02 при гидротермической обработке зерна пшеницы на свойства теста и хлеба / В. В. Петриченко, М. Г. Иванов, Е. И. Пономарева, О. Н. Воропаева // Хлебопродукты. – 2015. - № 5. – С. 51-54.


